



人体细胞电子被抢夺是万病之源,活性氧(自由基ROS)是一种缺乏电子的物质(不饱和电子物质),进入人体后到处争夺电子,如果夺去细胞蛋白分子的电子,使蛋白质接上支链..
预计2017年,我国共有90100人被诊断为胰腺癌,79400人死于胰腺癌。胰腺是腹膜后器官,因而胰腺癌早期并无特征性的症状和体征。同时因为胰腺和周围器官及血管关系密切,80%的初诊胰腺癌患者已失去根治性手术的机会;即使能够手术切除,患者的中位生存时间也不足2年。
对于不可切除的局部进展期或转移性胰腺癌,化疗带来的生存获益仍极其有限,采用FOLFIRINOX方案(氟尿嘧啶+伊立替康+奥沙利铂)、吉西他滨(GEM)+白蛋白结合型紫杉醇(nab-PTX)、GEM+替吉奥治疗的患者,中位生存时间仅为8~11个月。胰腺癌血管少、基质多的特征是否导致药物无法有效输送到肿瘤细胞,从而大大减弱了化疗的作用,值得探讨。
目前,唯一获得美国食品与药品管理局(Food and Drug Administration, FDA) 批准的靶向药物是厄洛替尼,但其在吉西他滨的基础上仅仅给患者带来了10d的生存获益,其他抗表皮生长因子受体(epidermal growth factor receptor,EGFR)药物(西妥昔单抗、帕妥珠单抗和尼妥珠单抗)、抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物、抗K-ras药物等的疗效均令人失望。
胰腺癌的分子生物学变异较多,单个靶点的阻断是否不足以阻断活化的肿瘤增殖通路,是否需要研究新的靶点和药物,能否根据生物标志分子来筛选靶向治疗潜在的获益人群,均是临床研究的热点。随着对于胰腺癌微环境和基因分子层面的深入认识,包括免疫治疗在内的抗微环境治疗能否成为一种新的治疗思路,分子分型指导下的精准治疗在胰腺癌中是否可行,这些问题均将直接影响临床实践。
本文将着重从胰腺癌生物学特征层面梳理近年来进展期胰腺癌的临床研究进展,以期更好地指导临床实践并为将来的研究设计积累经验。
一、有效输送抗肿瘤药物
与其他肿瘤不同,胰腺癌细胞被厚厚的纤维性基质包裹,这限制了细胞毒药物的作用。胰腺癌基质有很多富含半胱氨酸的酸性分泌蛋白(secreted protein acidic and richin cysteine,SPARC),nab-PTX可以通过白蛋白与SPARC的黏附作用从而更有效地杀伤胰腺癌细胞,nab-PTX+GEM被证实优于GEM。透明质酸是细胞外基质的主要成分,它可以通过增加组织间质液压从而阻碍药物的渗透作用。
聚乙二醇重组人源性透明质酸酶能够有效延长高透明质酸患者的生存时间。Ibrutinib(Bruton酪氨酸激酶抑制剂)可以抑制多种细胞因子,从而减少纤维性基质的形成。基于在血液系统肿瘤中的广泛应用以及在胰腺癌小鼠模型中的有效性,一项针对Ibrutinib的Ⅱ~Ⅲ期临床研究正在进行中(NCT02436668)。
一些动物研究证明,细胞外基质的破坏反而促进了肿瘤的局部侵袭和转移,因而导致了人们对于破坏细胞外基质这一治疗策略的担忧。但是,这一现象仅仅发生在肿瘤形成的早期阶段。对于进展期胰腺癌,破坏细胞外基质不仅能够增强细胞毒药物的局部浓度,也能够抑制肿瘤发展。
二、靶向治疗
在GEM的基础上,唯一获FDA批准的厄洛替尼仅仅能给胰腺癌患者带来10d的生存获益,这是否意味着靶向药物在胰腺癌的治疗中没有一席之地,值得我们思考。胰腺癌患者的K-ras基因突变率可达90%,因而单纯的抗EGFR治疗无法获得满意的疗效。Boeck等对AIO-PK0104试验的回顾性分析研究结果显示,K-ras野生型和突变型胰腺癌患者的中位生存时间分别为7.9和5.7个月,差异有统计学意义(P=0.005),提示K-ras野生型患者更能从抗EGFR治疗中获益。
我国正在进行的Ⅲ期临床试验(NCT02395016)旨在研究K-ras野生型患者是否能从抗EGFR治疗中获益。在进展期胰腺癌中,分子生物学变异较为常见,存在更多的信号通路被激活或抑制,因而单独使用某种靶向药物几乎均以失败告终。多种靶向药物的联合能否克服这一治疗的困境是目前研究的热点。
在GEM+厄洛替尼+贝伐珠单抗对比GEM+厄洛替尼的Ⅲ期临床试验中,患者的中位生存时间分别为7.1和6.0个月,差异无统计学意义(P=0.209)[10]。而西妥昔单抗+贝伐珠单抗+GEM对比贝伐珠单抗+GEM的一项Ⅱ期临床研究(NCT00326911)因无效而提前终止。这提示抗EGFR+抗VEGF治疗对于进展期胰腺癌效果不佳。在小鼠移植瘤模型中,帕尼单抗+曲妥珠单抗+MEK抑制剂具有协同抗肿瘤作用[11],然而目前并没有相关的临床研究。与此同时,也有一些新靶点及相应的药物被研发出来。
Na+/H交换亚单位1(NHE1)是EGFR信号通路中重要的一环,使用NHE1抑制剂联合厄洛替尼可减缓胰腺癌移植瘤模型中肿瘤的生长和侵袭[12]。但这一联合方案缺乏临床研究,且是否会受到EGFR通路下游K-ras基因突变的影响尚不明确。除致癌基因K-ras突变以外,经常发生突变的还有3种抑癌基因,TP53、SMAD4和CDKN2A,这些导致功能缺失的突变不易成为治疗的靶点,直到最近才有少数针对上述失活基因的药物进入胰腺癌的早期临床试验。
在p53缺陷的肿瘤中,若细胞复制阶段出现DNA受损,细胞周期检查点激酶1(cell cycle checkpoint kinase 1,CHK1)抑制剂可以使细胞带着受损的DNA完成细胞周期进程,使细胞更容易死亡。CDKN2A基因失活导致细胞周期蛋白依赖性激酶4和6(cyclin dependent kinases 4/6,CDK4/6)功能增强,从而参与肿瘤的发生和发展[15]。SMAD4突变则导致转化生长因子β(transforming growth factor,TGF-β)过表达,而TGF-β能促进肿瘤形成、浸润、迁移。
以上靶点的靶向治疗均开始了Ⅰ期临床试验,分别为CHK1抑制剂(NCT02797977)、CDK4/6抑制剂(NCT02501902)和TGF-β抑制剂(NCT00844064)。虽然现阶段并没有疗效显著的靶向药物,但是随着对胰腺癌分子机制研究的深入以及对疗效预测生物标志物的不断探索,有望使用新的靶点、药物和(或)多靶点联合方案,以期能为潜在的受益人群带来生存获益。
三、抗微环境治疗
胰腺癌微环境主要包括肿瘤相关的成纤维细胞(carcinoma-associated fibroblasts,CAFs)或胰腺星形细胞、免疫细胞、微血管和细胞外基质;其对于肿瘤的形成、进展和转移具有重要作用,且涉及化疗的耐药和肿瘤的免疫逃逸。因而在当前化疗及靶向治疗疗效不满意的背景下,抗微环境治疗逐渐成为目前研究的关注点。
1.抗成纤维细胞治疗
CAFs通过一系列的信号通路促进自身和肿瘤的生长。Hedgehog通路可以调节肿瘤与基质之间相互作用的重要因子,从而促进纤维增生、抑制胰腺癌细胞自噬,然而Hedgehog抑制剂的Ⅱ期临床试验却没有成功。Notch通路可以分泌肿瘤细胞生长所需要的酶,其抑制剂正在进行Ⅰ期临床研究。JAK/STAT3通路能够促进炎症反应,并介导肿瘤细胞与上皮细胞间的信号交流;JAK1/JAK2抑制剂Ruxolitinib能够给全身炎症反应的患者带来生存获益(P=0.011),目前正在进行JAK抑制剂的Ⅲ期临床研究[13,16-17]。
2.免疫治疗
胰腺癌的微环境中,免疫反应处于被抑制的状态。人们最初使用肿瘤疫苗来激活抗肿瘤的免疫系统,单用一种疫苗似乎能够给不能或不愿接受化疗的患者带来生存获益,然而却不能进一步延长化疗者的生存时间。目前,人们倾向于使用多种疫苗以更好地激活抗肿瘤免疫反应。
一项Ⅱ期临床试验的结果显示,使用GVAX+CRS-207和单用GVAX胰腺癌患者的中位生存时间分别为6.1和3.9个月,差异有统计学意义(P=0.02)[20]。
另一项Ⅱb期临床试验旨在对比GVAX+CRS-207和单用GVAX或化疗的疗效。新近出现的抗PD-1/PD-L1和抗CTLA-4治疗等免疫检查点阻滞疗法在肾癌、黑色素瘤和非小细胞肺癌中取得了突破性进展。然而在进展期胰腺癌中,单独抗PD-1/PD-L1或抗CTLA-4治疗却以失败告终,这提示胰腺癌微环境的免疫抑制程度可能更重,因而需要联合其他手段来更好地激活免疫系统。
正在进行的一项Ⅱ期临床研究旨在明确在使用GVAX+CRS-207的基础上,加用nivolumab是否可以给患者带来额外的生存获益。与此同时,CXCL12和其受体CXCR4结合同样能抑制免疫反应,CXCR4抑制剂联合抗PD-L1或抗CTLA-4药物的方案正在进行Ⅰ期临床试验(NCT02301130)。筛选潜在的受益人群同样可以优化胰腺癌中免疫检查点阻滞疗法在进展期胰腺癌中的应用。
Diaz等报道了PD-1抗体(pembrolizumab)在存在错配修复缺陷(mismatch repair deficiency,dMMR)的实体瘤中的疗效,其中纳入胰腺癌患者4例,有2例患者达到部分缓解,1例肿瘤缩小至疾病稳定状态,1例肿瘤体积无变化。
临床前研究的结果显示,肿瘤疫苗可以上调胰腺癌组织PD-L1的表达水平,在此基础上,加用PD-1抗体较单独使用PD-1抗体能够更好地刺激效应T细胞浸润肿瘤组织,延长生存时间。
这些研究结果提示,dMMR和PD-L1可以帮助我们选择抗PD-1/PD-L1治疗的人群。CD40是T细胞依赖性抗肿瘤反应的主要决定因子,同时也可以募集巨噬细胞发挥抗肿瘤作用。CD40激动剂已经在一项Ⅰ期临床研究中展现出应用前景。
然而,这些研究结果也显示,对CD40激动剂有反应的病变中富含巨噬细胞,而没有淋巴细胞。因此,就提出了以下问题:(1)在CD40激动剂的基础上加用PD-1/PD-L1抑制剂后,是否会因为病变中缺少淋巴细胞而导致PD-1/PD-L1抑制剂无效;(2)PD-1/PD-L1抑制剂激活T细胞(在微环境中原本被抑制)后是否可以使CD40募集T细胞参与抗肿瘤免疫反应。这些问题均需要基础研究及临床数据来给我们答案。
3.针对乏氧环境的治疗
胰腺癌微环境的另一大特征为乏氧状态。Evofosfamide是一个与硝基咪唑相连的前体细胞毒药物,在乏氧细胞还原酶的作用下释放DNA交联剂异磷酰胺氮芥溴化物。尽管取得了良好的Ⅱ期临床研究结果,但是其Ⅲ期临床试验却没有达到主要研究终点,Evofosfamide+GEM和单用GEM组患者的中位生存时间分别为8.7和7.6个月,差异无统计学意义(P=0.059),但Evofosfamide+GEM和单用GEM组患者的中位无进展生存时间和有效率的差异有统计学意义(P<0.05)。
临床前研究结果显示,Evo与nab-PTX+GEM、mTOR抑制剂、CHK1抑制剂联合使用后,疗效能够显著增加,这为今后Evofosfamide的临床试验奠定了理论基础。
四、分子分型带来的新视野
Waddell等根据染色体的结构变异将胰腺癌分为4个亚型:稳定型、局部重排型、分散型和不稳定型;并发现DNA维持基因的失活与不稳定型关系密切,此类患者对顺铂和多聚ADP核糖聚合酶抑制剂反应良好。
Bailey等根据整合的基因组分析和表达分析将胰腺癌分为4个亚型,鳞癌型、胰腺祖细胞型、免疫型和分化异常的内分泌/外分泌型。4种亚型预后不同,更重要的是,不同亚型具有不同的基因突变特征,因而可以为治疗的选择提供依据。如鳞癌型的基因表达类型和肺鳞癌、乳腺鳞癌、膀胱鳞癌相似(TP53突变及EGF通路活化等)。
提示此类型患者参考肺鳞癌、膀胱鳞癌等的治疗模式(如使用紫杉类+铂类化疗),可能有所获益,或使用抗p53或抗EGFR的靶向治疗可能疗效较好。同样,免疫型胰腺癌CTLA4和PD1高表达,提示免疫检查点抑制剂有潜在的应用价值。
五、总结与展望
破坏细胞外基质对于抗肿瘤药物(细胞毒药物、靶向药物等)到达肿瘤细胞起到了极为关键的作用,透明质酸酶和Bruton酪氨酸激酶抑制剂显示出了潜在的应用价值。当然,担心细胞外基质的破坏可能导致肿瘤侵袭及转移倾向增加并非不无道理,但对于进展期胰腺癌,似乎细胞外基质的减少对于控制肿瘤而言更为重要。我们期待更充分的临床数据来明确破坏细胞外基质这一治疗策略的地位和价值。
现有的靶向药物均未取得重大突破,新的靶向药物仅仅停留在临床前研究或Ⅰ期临床试验。随着生物学信息技术的不断发展和普及,我们希望能够找出与胰腺癌发生发展最为相关的信号通路,从而确定主要靶点并研发相应的靶向药物。同时探索多靶点联合治疗模式来更好地阻断肿瘤的发展。
更为重要的是,我们应该严格设计试验,以寻找生物标记来帮助我们预测靶向治疗的疗效,真正做到个体化及精准治疗。
抗微环境治疗对于胰腺癌极其重要,但微环境和信号通路极其复杂,动物模型并不能准确预测药物的临床效果,目前只有JAK抑制剂进入了Ⅲ期临床研究。尽管一些学者认为,肿瘤疫苗对于相对早期的胰腺癌可能效果更好,但疫苗的联合使用在进展期胰腺癌中也取得了一些成绩,我们将期待GVAX+CRS-207的Ⅱ期临床研究结果;
同样,在dMMR/MSI和PD-L1阳性患者中采用免疫检查点阻滞策略也值得密切关注[23-24]。尽管针对胰腺癌乏氧环境设计的evofosfamide并没有达到主要研究终点,但这一临界性的结果提示我们,仍需要探索evofosfamide最优的使用方法,来改善进展期胰腺癌患者的预后。
分子分型不仅与胰腺癌患者的预后相关,更为重要的是,它能够从化疗、靶向治疗及免疫治疗等各方面指导临床决策。此外,深度的基因检测还能够明确胰腺癌中的少见基因突变,为胰腺癌的精准治疗提供依据。
目前,胰腺癌的治疗手段有限,预后极差,我们希望多种药物治疗能够更有力的控制或缩小肿瘤,从而为更多的进展期胰腺癌患者带来生存获益,甚至是根治性手术的机会。同时,药物治疗在进展期胰腺癌中的进展也一定会成为降低早期胰腺癌患者术后复发和远处转移率的重要手段。
人体细胞电子被抢夺是万病之源,活性氧(自由基ROS)是一种缺乏电子的物质(不饱和电子物质),进入人体后到处争夺电子,如果夺去细胞蛋白分子的电子,使蛋白质接上支链发生烷基化,形成畸变的蛋白分子。该畸变的蛋白分子由于自己缺少电子,又要夺取邻近蛋白分子的电子,又使邻近蛋白分子也发生畸变。
这样,恶性循环就会形成大量畸变的蛋白分子,这些畸变的蛋白分子繁殖复制时,基因突变。形成大量癌细胞,最后出现癌症,造成组织损伤。
氧化应激对生物大分子损伤
不管是何种癌症最终转归是一样的。传统的治疗最终都是放疗或化疗,都会因放化疗而引起的细胞毒性而出现各种并发症。患者往往不是死于癌症本身,而是死于并发症。
放射治疗简称放疗,它是利用高能电磁辐射线作用于生命体,使生物分子学结构改变,以破坏肿瘤细胞为目的的一种治疗方法。放射能够治疗肿瘤是因为恶变细胞对放射线敏感。
目前临床上应用的放射线有X线治疗和r线治疗两种。临床根据肿瘤对不同剂量放射线的反应不同可分为三类:一类是对放射敏感的肿瘤,常照射50~60GY,肿瘤即消失,如淋巴瘤、精原细胞瘤、无性细胞瘤及低分化的鳞状上皮细胞瘤、小细胞未分化型肺癌等。另一类属是中度敏感的肿瘤,要照射到60~70GY左右,肿瘤才消失。再一类是对放射不敏感的肿瘤,其照射量接近甚至超过正常组织的耐受量,放射治疗的效果很差,如某些软组织肉瘤和骨的肿瘤等。
化学疗法是将化学制剂经血管带到全身,对身体所有细胞都有影响。这种疗法有时也称为“胞毒疗法”,因为所用药物都是有害的,甚至是带毒性的,体内细胞,无论是否恶性细胞,都受到破坏。
中医治疗肿瘤现在已经被国内外医疗专家广泛的认可,大量的临床试验及科研研究已经证实了中医治疗肿瘤的效果。在古代的医疗文献中,早有关于肿瘤的病因、病名以及治疗方法,例如乳岩(即乳腺癌)、肾岩(又称肾岩翻花,即龟头癌)、舌岩(即舌癌)、噎膈(即食道癌)、症瘕积聚(各种腹部肿瘤或转移癌)、恶疮(即皮肤癌)、瘿瘤(即淋巴癌或转移癌)、鼓胀(癌症并发腹水)、癃闭(尿路肿瘤)等等。治疗方面主要有两种方法,即口服及外用制剂、针灸截根疗法。
传统方法治疗癌症的不足
现有抗肿瘤制剂多不改善氧化应激。症状控制不好是造成癌症患者体内氧化应激升高的主要原因之一,即使症状控制良好,但是患者病灶及各脏器并不代表其氧化应激造成的损伤得到遏制。故而修复受损的脏器组织固有细胞细胞才是解决疾病的根本。
目前全球用于治疗肿瘤的各类化学制剂,均是通过控制症状来缓解病情,患者病灶的固有细胞受损和肝肾功能损伤却极少得到改善,多数情况下还受到进一步损伤。
中医多靶点渗透修复疗法
根据患者的检验结果,经专家组会诊分析整合信息后,拿出合理的治疗方案,将有效的有效的纯天然草本植物在实验室进行超微粉化,在粉化的过程中其活性分子处于激发状态,价键悬空、结构位移、电子跃迁,形成生物学分子重组。重组后制剂中的活性物质对脏器或组织固有细胞具有阻断损伤细胞的基因突变进程、修复损伤固有细胞、重建脏器或组织的正常结构,恢复组织脏器的应有功能。
多靶点修复治疗
该“疗法”主要是在电磁场作用下将修复变异基因的活性物质:即基因细胞激活素,变异基因调控因子,免疫系统激活因子,植物活性蛋白因子等导入肿瘤病人体内,起到激活与修复变异基因;(降低其易感性;增强机体免疫能力,恢复固有细胞正常功能)。
三大治疗措施来阻断癌细胞基因突变
一:通过净化病人体内内环境紊乱,缓解代谢紊乱导致的基因突变
1、抗炎的作用,阻断基因突变进程
氧自由基的过度产生可引发固有细胞的炎性损伤,炎症促进氧化应激,而氧化应激又加剧炎症反应,同时又都促进肿瘤及其并发症的发生,由此形成恶性循环。制剂中活性物质进入体内,通过抗炎、抗氧化来净化环境,减轻炎症反应。通过抗炎症的功能来抵抗氧自由基所致的炎性反应,抑制炎症性反应,杀伤炎症因子,阻断基因突变进程,防止代谢紊乱而导致的基因突变。
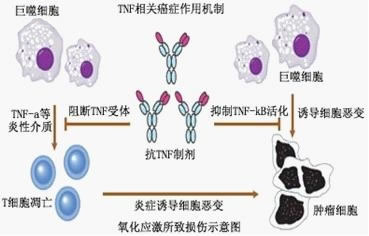
2、通过扩血管,改善微循环障碍
氧自由基的过氧化杀伤,主要是破坏细胞膜的结构和功能,同时也可以使血管壁上的粘合剂遭受破坏,血管变得千疮百孔,导致机体组织缺血缺氧,血液循环障碍。多靶点渗透疗法通过扩血管靶点治疗措施,为损伤细胞的修复提供有利的营养物质,改善微循环障碍,使突变的基因逆转,组织脏器的固有细胞得以恢复。
二:通过修复病变基因的易感性,恢复其功能来消除基因突变
1、重建细胞功能,逆转变异的受体基因
一是要重建组织脏器的细胞功能,并通过受体基因的活化来解决基因突变问题;重建应有功能。二是逆转变异的受体基因,重建膜受体功能,改变异常的组织细胞的摄取功能,提高各类细胞对能量、营养物质的摄取和利用问题,真正解决代谢紊乱和基因突变问题,恢复细胞应有活性。
2、富含丰富的营养物质,增强抵抗力,满足能量需求
活性物质中含有丰富的氨基酸和维生素可以有效改善组织细胞功能帮助调节免疫。对癌症的治疗从控制和改善并发症两方面起积极的辅助治疗作用。同时又能满足癌症患者的能量需求,增强抵抗力,提高癌症患者的体质。增加组织细胞的敏感性,促使组织细胞结构逆转,恢复机体正常免疫能力。
三:启动组织细胞自我修复,调控变异基因表型逆转,解除脏器组织基因突变
1:纠正变异基因转型
活性物质中含有修复调控变异基因表型调控因子、修复过程是通过基因细胞激活素,变异基因调控因子,免疫系统激活因子,植物活性蛋白因子等这些活性物质靶向进入病灶内,发挥促使细胞分化、增殖、分裂与再生;促使蛋白酶的活化与DNA的复制,启动细胞的自我更新过程。从而细胞内微粒体向细胞内转位,纠正变异基因转型。
2:修复癌变形成的损伤
修复过程是通过活性物质直接进入病灶内,靶向定位于变异的基因,促使变异基因的基因表型(形态、结构、功能)向符合生理需求的方向逆转。该过程是治疗的关键,如果变异基因表型逆转成功,就会很快进入基因修复的活化状态,增强正常细胞的的活性。迅速恢机体免疫调控的调控,快速修复恶变形成的损伤。
总之,生物多靶点消癌法已成为21世纪最有希望最有前途的肿瘤治疗模式,目前在临床上已取得不错的成就,是肿瘤治疗技术的新突破,相信生物多靶点消癌法会成为21世纪肿瘤治疗技术的新宠。
联系微信/QQ:1151591580
 肿瘤可以治愈吗?费用多少?点击此处免费咨询在线医�?/a>
肿瘤可以治愈吗?费用多少?点击此处免费咨询在线医�?/a>
防医托、防欺骗,不要轻信他人,治疗肿瘤疾病请选择正规的肿瘤医院。如果您对于以上文章的内容还有疑问,可以点击下面的按钮,与医生在线一对一交流�?/p>


公众微信二维码
关注"一生不得癌症秘诀"
微信/QQ:1151591580